摘要:炎癥性腸病(IBD),主要包括潰瘍性結腸炎(UC)和克羅恩病(CD),是一組慢性、特發(fā)性、異質(zhì)性腸道炎癥性疾病,在世界范圍內(nèi)尤其歐美地區(qū)影響非常廣泛。該領域近年來上市了多款重磅藥物,并且大量在研產(chǎn)品也即將進入市場。IBD藥物治療格局正在迅速發(fā)生改變。那么究竟有哪些改變?變化的趨勢是什么?biotech公司在立項上該如何應對?本文將根據(jù)我們收集的資料以及以往的項目經(jīng)驗嘗試對這些問題進行回答。
作者:優(yōu)選資本 趙鐵
炎癥性腸病(IBD),主要包括潰瘍性結腸炎(UC)和克羅恩病(CD),是一組慢性、特發(fā)性、異質(zhì)性腸道炎癥性疾病,在世界范圍內(nèi)尤其歐美地區(qū)影響非常廣泛。該領域近年來上市了多款重磅藥物,并且大量在研產(chǎn)品也即將進入市場。IBD藥物治療格局正在迅速發(fā)生改變。那么究竟有哪些改變?變化的趨勢是什么?biotech公司在立項上該如何應對?本文將根據(jù)我們收集的資料以及以往的項目經(jīng)驗嘗試對這些問題進行回答。
中重度IBD治療加速進入以生物制劑為核心的時代
如果說20多年前Infliximab(IFX)獲批,已經(jīng)意味著IBD治療進入生物制劑時代,那么近些年隨著各種anti-TNFα,Natalizumab,Vedolizumab,Ustekinumab以及Tofactinib(小分子靶向藥物)獲批用于IBD治療,臨床上已經(jīng)需要選擇單抗藥物進行應用。不僅如此,還要考慮單用還是聯(lián)用,是否需要早期應用生物制劑進行治療等問題。
盡管證據(jù)級別非常低,AGA(American Gastroenterological Association)在今年1月新鮮出爐的《中至重度潰瘍性結腸炎的管理臨床實踐指南》已經(jīng)建議在中重度UC患者中早期使用生物制劑,而不是逐漸升階梯治療。這似乎吹響了某種決戰(zhàn)的號角,中重度IBD的治療正在加速進入以生物制劑為核心的時代。

AGA建議在中重度UC患者中早期使用生物制劑
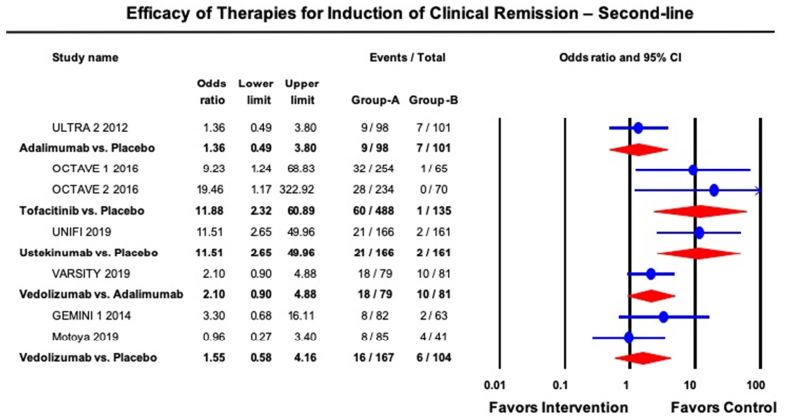
AGA在發(fā)布UC管理指南的同時伴隨發(fā)布了相關技術綜述,對已上市多種生物制劑及Tofactinib進行了療效和安全性的比較。由于大部分為非頭對頭試驗的結果,所以計算緩解率時需要合并安慰劑組并采用多種統(tǒng)計方法包括network meta-analysis等。該技術綜述還納入了2019年下半年最新公布的vedolizumab vs Adalimumab的頭對頭試驗[VARSITY]以及UST的RCT試驗[UNITI]的結果。最終療效的比較結果為指南推薦的一、二線生物制劑提供證據(jù)支持。AGA指南推薦的詳細內(nèi)容這里不詳細介紹,有興趣可以參考文后的參考文獻。
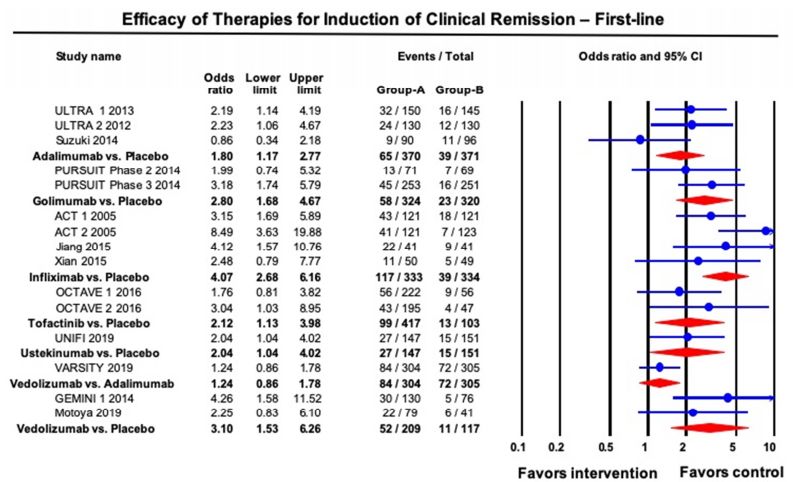
(上)中重度UC一線誘導緩解治療的藥物療效(沒有用過生物制劑的患者)Pair-wise meta-analysis
(下) 中重度UC二線誘導緩解治療的藥物療效(用過anti-TNFα生物制劑的患者)Pair-wise meta-analysis
盡管有多個生物制劑上市,但仍然有較多未被滿足的臨床需求
在眾多上市的生物制劑中,IFX仍然是一線治療的首選,Vedolizumab和其他anti-TNFα以及Ustekinumab和JAK抑制劑由于各自的MOA不同、給藥途徑優(yōu)勢或成本效益比優(yōu)勢等原因也能占據(jù)部分患者群體。但從現(xiàn)有的臨床數(shù)據(jù)看,中重度IBD能夠得到完全臨床緩解的比例大致在50%左右。而且達到臨床緩解的患者依然面臨一定比例的復發(fā)和耐藥。
此外,安全性和依從性仍然存在較大未被滿足臨床需求。
安全性永遠是慢性病用藥追求的重要目標,即使生物制劑的副作用已經(jīng)遠比激素或免疫抑制劑等傳統(tǒng)藥物小。Vedolizumab雖然療效沒有頭對頭的與IFX的PK數(shù)據(jù),但是從network meta-analysis結果來看,Vedolizumab較大可能不會超越IFX(可能也不敢去做這個頭對頭試驗)。但是Vedolizumab的藥理作用集中在腸道部位,明顯降低了全身的毒副作用,因此獲得了較好的臨床地位。一個反面的例子是已經(jīng)上市的Tofactinib。盡管Tofactinib具有新穎的MOA及一、二線較好的療效,但僅僅在二線排在Ustekinumab之后獲得AGA的建議。因此,安全性具有明顯優(yōu)勢且作用機制差異化的靶向化藥或生物制劑仍將獲得較好的市場份額。
依從性對于IBD來說也是防止復發(fā)的重要因素。依從性一個主要的影響因素是給藥途徑。目前來講,SC和PO較靜脈注射有一定優(yōu)勢,同時也占據(jù)了成本-效益比的優(yōu)勢。用藥頻率低于每半月一次的SC和高于每天一次的口服藥物很難說誰更有優(yōu)勢。阿達木單抗就是一個SC注射給藥,而在IBD日益競爭激烈的格局中仍然占有一席之地的例子,即使是在Vedolizumab頭對頭比較優(yōu)于阿達木單抗結果出來后,仍然有多位學者力挺阿達木的價值。Ustekinumab則直接開發(fā)成有SC給藥劑型。這也是Vedolizumab希望上市皮下劑型 (108mg SQ every 2 weeks)的原因(但上市申請近期被FDA拒絕)。武田收購shire得到的SHP647也是直接做成SC給藥,可見這是目前IBD領域的一個趨勢。
盡管UC的治療條件一直在改善,但UC患者的長期結腸切除率在過去十年中并未下降,這一事實凸顯了對新型生物制劑及新機制藥物的需求。
在研新藥百花齊放,緩解臨床需求,但加劇競爭
2019年4月Informa數(shù)據(jù)庫的一項調(diào)查顯示,47家公司在IBD治療領域開展了70種上市前或后藥物的臨床研究,其中包括43種用于UC, 29種用于CD, 6種用于兩種適應癥。
目前上市和在研IBD治療藥物主流或常見的MOA包括抗細胞因子、抗粘附(包括T細胞歸巢)、微生物制劑、干細胞再生、屏障修復劑、PDE-4抑制劑、JAK抑制劑、抗淋巴細胞等。
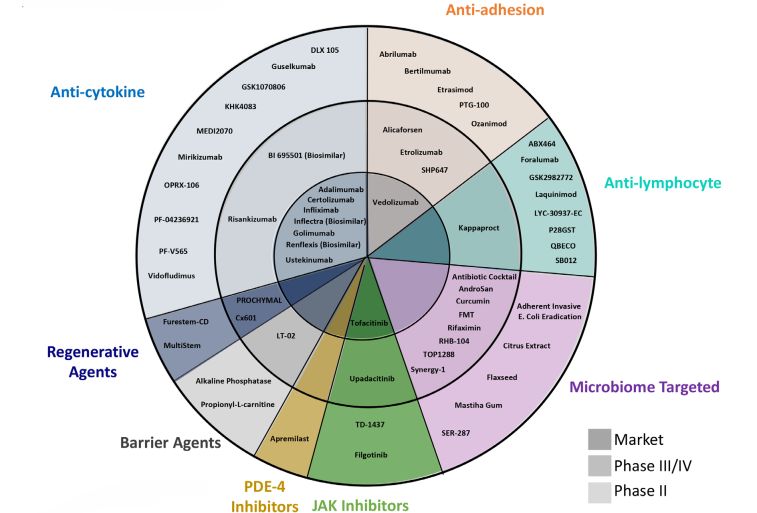
部分常見的上市和在研IBD治療藥物及MOA分類
抗細胞因子、抗粘附(包括T細胞歸巢)、JAK抑制劑三種MOA已經(jīng)有上市藥物,并且仍在持續(xù)的開發(fā)或改良。比如,AJM300 (Carotegrast) (EA制藥)是一種口服的小分子,針對α4整合素參與淋巴細胞歸巢到腸道和大腦。UC的2期臨床試驗顯示,與安慰劑相比,8周時臨床反應、緩解和粘膜愈合率顯著提高,但CD患者中沒有觀察到顯著差異。Protagonist Therapeutics與Jassen合作利用其環(huán)肽技術開發(fā)口服腸道限制性的α4β7整合素拮抗劑PTG-100及下一代分子PN943,和同樣為口服腸道限制性的IL23R(p19)抑制劑PTG200(JNJ-67864238)。PTG-100已經(jīng)在UC患者中做過一個2a期臨床,經(jīng)過內(nèi)鏡重讀后,臨床緩解率為15.8%,組織緩解率為44%。PN943也已經(jīng)完成了臨床1期,即將開展2期研究,預期結果會優(yōu)于PTG100。PTG200也即將進入臨床2期。Theravance也與Jassen合作開發(fā)口服腸道選擇性pan-JAK抑制劑TD1473(JNJ-8398),適應癥包括UC和CD。1期結果顯示UC患者系統(tǒng)暴露量明顯降低,而結腸組織內(nèi)濃度(80mg劑量)可以達到JAK抑制劑的IC50范圍。這種對腸道的高度選擇性,有望提高JAK抑制劑有效性和安全性。其他MOA藥物仍在不斷的探索,試圖證明自己,但有不少都經(jīng)歷過了失敗。不過我們還是可以看到一些希望。比如,粘膜修復劑中,盡管雀巢的LT-02(磷脂酰膽堿)以誘導緩解為目標的2期臨床試驗失敗,但還是有理由推測憑借其安全性有希望成為已獲得緩解的UC患者的維持治療藥物。雖然干細胞移植再生廣泛應用還面對很多阻礙(如安全性),但仍相信未來它可能在IBD治療中發(fā)揮重要作用。
其他部分在研的全新MOA或者改良藥物基本情況如下:
Phase 1:
Aevi Genomics已經(jīng)與Kyowa Kirin合作開發(fā)了AEVI-002,這是一種全人源單抗,它結合了一種在腸道組織中發(fā)現(xiàn)的被稱為LIGHT的炎癥蛋白。相關試驗正在評估AEVI-002治療兒童嚴重CD的療效。
Assembly Biosciences正在對輕度至中度活躍UC患者進行活體生物藥(live biotherapeutic product,LBP)候選藥物ABI-M201的1b期臨床試驗。Assembly和Allergan已經(jīng)開始合作,共同開發(fā)用于UC、CD和腸易激綜合征的LBP化合物。ABI-M201是此次合作的第一個LBP候選藥物。
Enterome與武田合作,共同開發(fā)和商業(yè)化一個first-in-class、非全身性的口服小分子EB8018(TAK018)。EB8018可以阻斷細菌表達細菌毒性因子FimH(腸道炎癥級聯(lián)反應的關鍵誘導因子),從而減少CD患者的腸道炎癥。EB8018治療術后CD已經(jīng)進入臨床2期,活動CD的1b期臨床試驗也接近完成。
Gossamer Bio正在開發(fā)口服HIF-1α穩(wěn)定劑GB004。2019年年第二季度開始進行活躍性輕度至中度UC 1b期研究的患者登記,公司預計2020年上半年公布研究的主要結果。
OSE Immunotherapeutics具有一個針對免疫腫瘤和自身免疫性疾病的藥物管線。OSE-127是這條管線中的藥物之一,它是一種靶向CD127受體(IL-7受體的α鏈)的單克隆免疫調(diào)節(jié)抗體,對效應T淋巴細胞產(chǎn)生強烈的拮抗作用。IL-7受體的阻斷阻止了致病性T淋巴細胞的遷移,同時保留了對自身免疫性疾病有積極影響的調(diào)節(jié)性T淋巴細胞。第一批患者于2018年12月進行了1期試驗。
Phase 2:
羅氏的另一款非免疫抑制療法IL22-Fc蛋白已進入臨床2期階段。非臨床研究證明IL22-Fc蛋白具有多重功能:它能夠通過提高上皮細胞增生來刺激組織再生;提高黏液生產(chǎn)來加固腸道屏障;并且可以調(diào)節(jié)腸道菌群失調(diào)。在1期臨床試驗中,這款在研療法已經(jīng)表現(xiàn)出可以接受的安全性,并且在健康志愿者和UC患者中表現(xiàn)出劑量依賴性藥物活性。
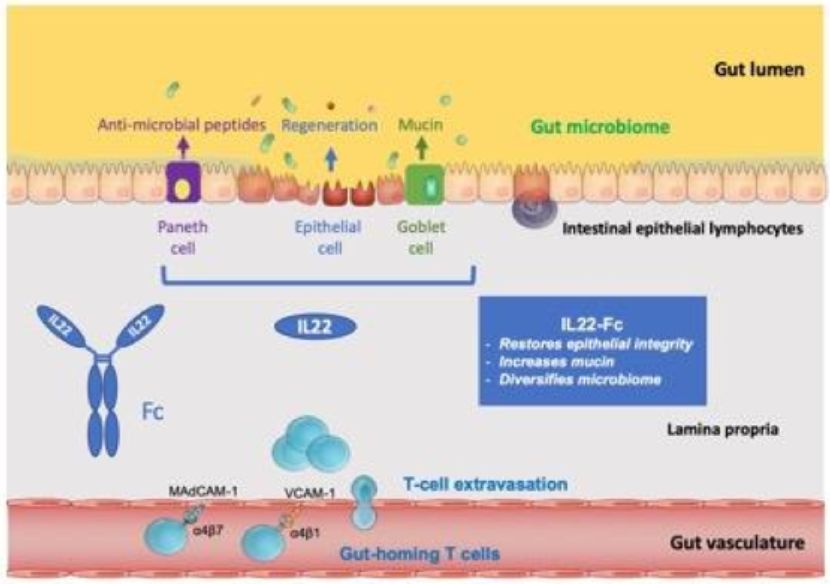
IL22-Fc蛋白作用機制
Bridge Biotherapeutics正在評估一種Pellino-1小分子抑制劑BBT-401。Pellino-1是一種連接酶,被視為多種免疫受體信號通路的關鍵介質(zhì)。BBT-401在80名健康志愿者的1期研究中被證明具有良好的耐受性和安全性。此外,還有研究數(shù)據(jù)顯示其沒有或只有最少的全身暴露的關鍵特征。目前,一項隨機、安慰劑對照、劑量遞增的2期試驗正在招募48名UC患者。
百時美施貴寶的BMS-986165是一種口服、選擇性酪氨酸激酶2(TYK2)抑制劑。TYK2是一種細胞內(nèi)信號激酶,介導細胞因子驅動的免疫和促炎癥信號通路,在免疫介導疾病的慢性炎癥循環(huán)中起關鍵作用。2018年銀屑病患者的2期試驗成功完成。目前正在進行兩個2期試驗,CD和UC各一個。
禮來公司正在研制mirikizumab(LY 3074828),這是一種人源化IgG4單抗,可結合并抑制IL-23的p19亞單位。克羅恩病患者2期SERENITY試驗和UC 2期試驗均報告陽性結果。兩項試驗均表明,與安慰劑相比,mirikizumab治療的患者在12周時獲得的臨床緩解率和內(nèi)窺鏡檢查癥狀減輕率顯著提高。禮來目前正在進行CD和UC的2期和3期的臨床試驗。
Gilead與Galapagos NV合作正在研究一種高度選擇性JAK1抑制劑filgotinib。2期研究FITZROY的結果于2017年12月發(fā)表在《柳葉刀》上。本研究探討了filgotinib治療活躍性中重度CD的療效和安全性。數(shù)據(jù)顯示,與安慰劑相比,filgotinib治療后臨床緩解患者明顯增多,且具有可接受的安全性。目前有7個正在進行的2期和3期試驗,包括MANTA、DIVERSITY、DIVERGENCE2和SELECTION1。
Immunic Therapeutics正在開發(fā)一種可抑制二氫硼酸脫氫酶(DHODH)的小分子藥物口服片劑。Immunic在2017年完成了兩項1期研究,評估了健康志愿者每天一次或重復使用IMU-838的劑量,研究結果支持每天重復給藥高達50mg的IMU-838的耐受性。目前,Immunic的2期試驗CALDOSE 1正在對UC進行研究。
Seres Therapeutics的SER-287是一種使用Seres專有的微生物治療平臺開發(fā)的口服膠囊。它屬于生物來源,包含一個活的和多種細菌孢子的聯(lián)合體。SER-287被設計用來減少免疫激活的觸發(fā)而非抑制免疫系統(tǒng)。UC患者的1b期試驗結果顯示,SER-287微生物組治療可提高臨床緩解率和內(nèi)窺鏡診斷評分。2期試驗ECO-RESET目前正在招募200名18?80歲患有活躍性輕度至中度UC的成年人。
Sublimity Therapeutics利用Sublimity專有的SmPill?給藥系統(tǒng)開發(fā)出一種口服環(huán)孢素制劑,稱為ST-0529。與傳統(tǒng)口服或靜脈注射環(huán)孢素不同,SmPill?技術能夠將環(huán)孢素準確地直接輸送到結腸病變組織中,從而最大限度地減少全身暴露和不必要的副作用。在一項2a階段的研究中,ST-0529顯示出良好的安全性和耐受性。一項2b階段的研究AURORA(CYC-202)目前正在招募280名中度至重度UC患者。
隨著新藥的不斷研發(fā),IBD未被滿足的臨床需求一定會得到一定程度地緩解,但同時也會帶來競爭的加劇。以抗粘附(包括T細胞歸巢)藥物為例:除Natalizumab、Vedolizumab、Etrolizumab,在研的SHP647和口服的α4β7小分子抑制劑等之外,還包括在研的ozanimod、etrasimod等一眾S1PRa類藥物。選手眾多且具有相似的作用機理,競爭關系非常復雜。S1PR小分子激動劑相對抗α4β7抗體最大的優(yōu)勢就是可以口服,但S1PRa存在理論上的進行性多灶性白質(zhì)腦病(PML)風險(盡管諾華報道芬戈莫德沒有明顯的PML),除非具有腸道特異性,否則將有可能受限于治療窗,影響對IBD的療效。而且α4β7靶點也正在開發(fā)口服小分子抑制劑,對S1PRa類藥物不利。Natalizumab受到PML的限制基本已經(jīng)退出了IBD的競爭,Vedolizumab暫時取得領先,但羅氏的Etrolizumab (RG7413/rhuMAb Beta7) 靶向β7亞單位,同時拮抗T細胞的歸巢和駐留,有望進一步提高療效。最近,在抗TNFα難治性CD患者的3期臨床試驗BERGAMOT中顯示了早在6周和持續(xù)14周的比Vedolizumab更高的癥狀和內(nèi)鏡緩解率。而且Etrolizumab也同時開發(fā)了SC版本。很難說長效的SC版本和PO版本那個更具有優(yōu)勢,這更加劇了該MOA藥物的競爭。
新藥預期市場份額縮水,開發(fā)難度加大
IBD作為慢性病的特點是患病率較高但發(fā)病率一般,也就是存量病人較多,而新增病人不會太多(歐美高發(fā)地區(qū)每10萬人的發(fā)病率CD>6.38,UC>7.7,患病率CD>135.6,UC>198)。IBD存量市場是兵家的必爭之地,也是主戰(zhàn)場。而誘導緩解仍然是該病的主要挑戰(zhàn),但一旦達到緩解,尤其是無激素緩解,該藥物是否將持續(xù)作為緩解期用藥?現(xiàn)有藥物能夠維持緩解期多長時間?現(xiàn)有藥物又能夠誘導多少患者進入緩解期?這些問題對分析IBD治療的存量市場至關重要。
《clinical gastroenterology and hepatology》發(fā)表的一篇論文顯示停用英夫利昔單抗會增加UC患者復發(fā)風險。目前,尚缺乏足夠證據(jù)給出何時停用IFX的推薦意見。對IFX維持治療達1年、保持臨床無激素緩解、黏膜愈合、CRP正常者,可考慮停用IFX,繼以免疫抑制劑維持。停藥后復發(fā)患者重新給予IFX,80%患者可再次獲得臨床應答。
如下圖所示,一項長期的隨訪研究告訴我們IFX單抗5年的復發(fā)風險約為25%,10年的復發(fā)風險約為50%,我們可以大致推出持續(xù)使用IFX5年的緩解率為75%,10年的緩解率為50%。
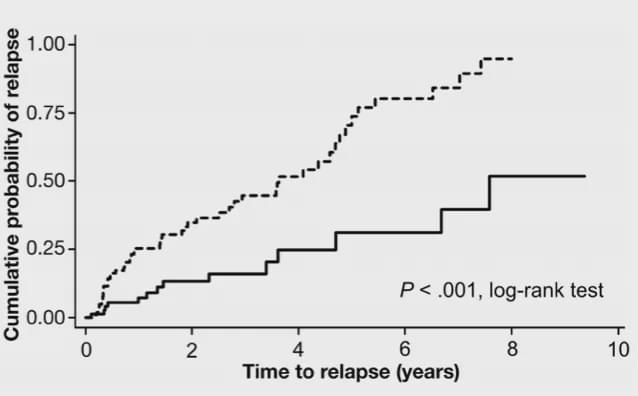
10年內(nèi)停用和連續(xù)使用英夫利昔單抗復發(fā)風險的Kaplan-Meier曲線
其他生物制劑是否也能達到類似的緩解程度呢?由于Vedolizumab和Ustekinumab上市時間較短,暫未發(fā)現(xiàn)有超過5年的隨訪研究結果。
Ustekinumab有一項針對CD的3年隨訪研究。該試驗入組患者近400人,臨床緩解率從60%左右(由于0周時入組的患者是主要8w誘導緩解期結束時有響應的患者,因此緩解率起始就低于100%)下降至40%左右。表面上看Ustekinumab似乎維持緩解的效果沒有IFX好,但實際上仔細剖析試驗設計可以發(fā)現(xiàn),該試驗有近一半左右的入組患者(來自于UNITI-1研究)有anti-TNFα生物制劑難治性的歷史。而從該試驗結果中可以看出,這類患者在8周時誘導緩解率相對更低,44周時的維持緩解率也更低。因此,這部分患者是造成152周時緩解率下滑近三分之一的主要動力。如果剔除這部分患者,則剩下的入組患者(來自于UNITI2)44周時維持緩解率僅下降了6%左右,預期152w時下降不超過20%。這與IFX持續(xù)給藥的維持緩解試驗的結果近似。
其實,IFX復發(fā)的患者中還有一部分是因為產(chǎn)生了抗藥抗體。但這部分患者可以通過優(yōu)化藥物劑量或者更換免疫原性更低的其它TNFα抗體,比如阿達木單抗重新獲得緩解。
因此,如果說生物制劑的十年維持緩解率可能超過50%并不過分。也就是說,多數(shù)使用單個生物制劑達到臨床緩解的患者可以維持5年以上的緩解,過半數(shù)可以維持10年以上的緩解。
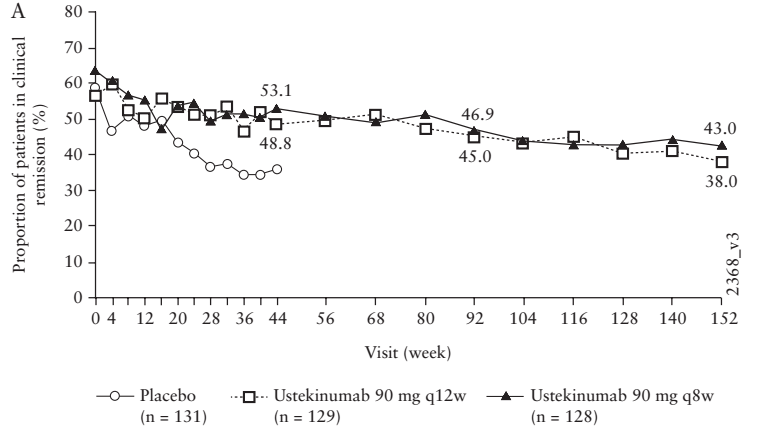
Ustekinumab治療152周內(nèi)CD患者誘導和維持臨床緩解的患者比例
以IFX為首的anti-TNFα一線生物制劑可以誘導緩解約20-35%的IBD患者。接受二線Ustekinumab治療(使用過anti-TNFα生物制劑)的CD患者中8周臨床緩解率有20%左右(如下圖所示,其中UNITI-1為2線使用Ustekinumab),而UC患者(使用過anti-TNFα的生物制劑約占一半)中8周臨床緩解率為15%。經(jīng)粗略計算后我們推出可以誘導接近40%左右的IBD患者達到臨床緩解。再加上Vedolizumab、Tofactinib以及未來上市的Etrolizumab等,相信整體可以使50%左右的中重度IBD得到臨床緩解,其中有部分可以實現(xiàn)無激素緩解。
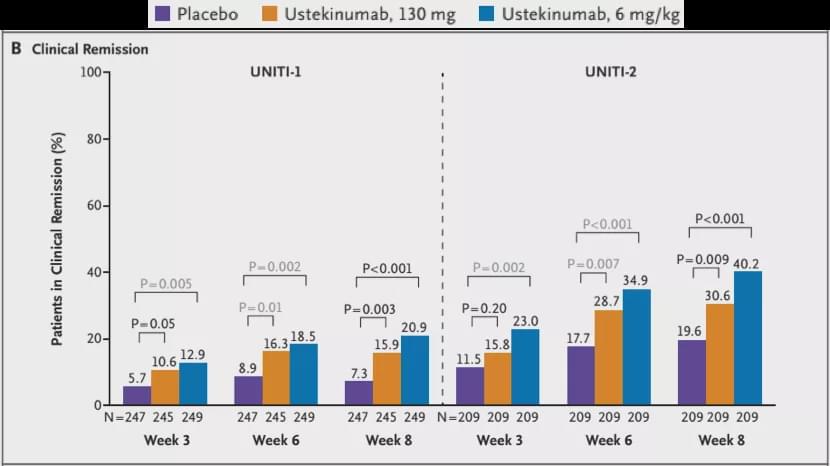
CD患者接受Ustekinumab治療誘導臨床緩解的比例
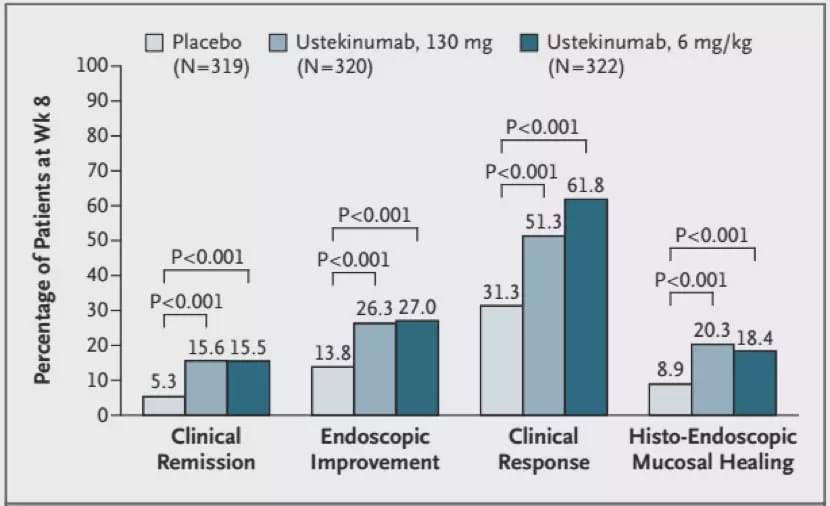
UC患者接受Ustekinumab治療8周時臨床緩解、內(nèi)鏡改善、臨床響應和組織-內(nèi)鏡粘膜愈合的比例
如果把每一個IBD藥物比作一張“漁網(wǎng)”,存量IBD患者比作一個魚塘里面的“魚”,則綜合上述分析,每一個漁網(wǎng)會在這個魚塘中捕捉到一定比例的魚,并且5-10年只有較少的魚會漏出漁網(wǎng)回到魚塘。目前,這樣的漁網(wǎng)可以捕捉到整個魚塘中約50%左右的魚。即使早期撒下的漁網(wǎng)已經(jīng)有部分魚漏出回到魚塘,這部分魚也很可能又被新的漁網(wǎng)捕捉到。因此,至少5年內(nèi),魚塘內(nèi)50%的魚是被這些新老漁網(wǎng)捕獲而不會輕易漏出回到魚塘的。也就是說50%的市場份額至少在5年內(nèi)很少釋放出來。而隨著更新的“漁網(wǎng)”撒進魚塘,被這些漁網(wǎng)長期捕獲的魚比例繼續(xù)增加是大概率事件。

除了市場份額已經(jīng)開始逐漸減少,新藥開發(fā)需要跨過的barrier也越來越高。僅考慮新MOA的產(chǎn)品(非安全性或給藥途徑改良產(chǎn)品或聯(lián)合治療定位的產(chǎn)品),如果想進入后線治療,其臨床試驗的入組人群將至少是anti-TNFα、Vedolizumab或Etrolizumab治療過無效、耐藥或無法耐受的患者甚至是Ustekinumab或Tofactinib治療過無效、耐藥或無法耐受的患者,難度可想而知。如果想進入一線治療(biologic naive),則大概率需要做與現(xiàn)有一線主要生物制劑的頭對頭臨床試驗,以獲得充分的數(shù)據(jù),從而獲得臨床醫(yī)生的支持,才能在一線激烈競爭中獲得一席之地。
IBD的發(fā)病機制非常復雜,新的MOA治療藥物屢遭失敗。IL17和IL13單克隆抗體治療,以及有效地利用IL10來直接調(diào)節(jié)免疫反應均未能成功,盡管有令人信服的證據(jù)表明所有這些細胞因子是參與IBD的炎癥反應的。
IBD異質(zhì)性也非常大。很難有新的MOA可以覆蓋大量患者群體。而且隨著研究的深入,生物制劑和靶向藥物增加,在IBD領域精準醫(yī)療的概念也已經(jīng)提出。這意味著根據(jù)易感基因、治療響應、動態(tài)監(jiān)測等進一步對患者群體進行分層的時代即將來臨。大“漁網(wǎng)”(適應人群廣泛的藥物)的出現(xiàn)將變得越來越困難。
臨床試驗終點目標和招募難度水漲船高
受到各種條件的限制,臨床試驗的設計和結果與最終的臨床應用場景及預后之間總會存在或多或少的gap。彌補這一gap需要不斷的優(yōu)化試驗設計或補充更多的臨床試驗。當前,IBD治療正朝著更好的預后發(fā)展。這需要不斷優(yōu)化治療的臨床評價標準。相應地,藥物臨床試驗的終點指標也水漲船高。
以UC為例,近些年的RCT臨床試驗設計中,內(nèi)鏡、組織學、生物標記物以及PROs(patient reported outcome,主要包括患者生存質(zhì)量評分)作為關鍵療效和安全性結果的比例正在提高。
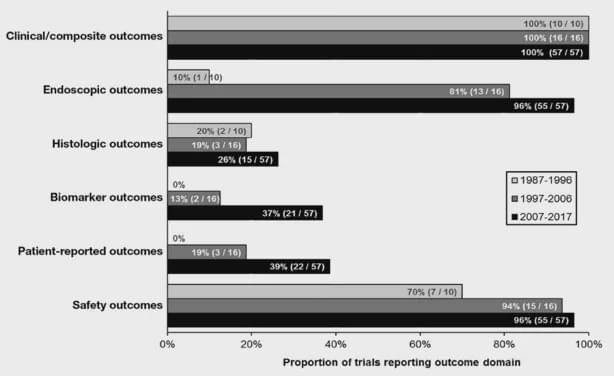
內(nèi)窺鏡終點幾乎已經(jīng)普遍作為當前RCT的評價結果。然而,粘膜愈合的準確定義仍然存在爭議。雖然大多數(shù)RCT使用MCS子評分cut off值≤1, 但是目前仍不清楚嚴格的定義MCS評分為0的粘膜愈合是否與長期效果改善相關?(盡管近期的多項研究包括前瞻性隊列研究顯示Mayo內(nèi)鏡評分1分比0分的患者更容易在1年內(nèi)發(fā)生疾病復發(fā),回顧性研究顯示Mayo內(nèi)鏡評分1分患者的復發(fā)風險是評分0分患者的3倍)。而這些定義反過來可能影響報告的有效率結果。除了內(nèi)鏡結果外,組織學終點也被越來越多地采納。“深度緩解”,定義為伴隨著組織學炎癥消退的粘膜愈合,可能預測UC改善的長期預后。而且,F(xiàn)DA提出了這樣的說法,只有在包含組織病理學評估結果的情況下,粘膜愈合才會被承認。但是,缺乏充分驗證的設備或普遍接受的定義以測量組織學響應或緩解是在UC臨床試驗中應用組織病理評估的一個主要限制。去年10月,在獲得治療UC的上市批準后,強生宣布Ustekinumab是迄今為止第一個也是唯一一個以組織-內(nèi)鏡粘膜改善為終點評價腸道改善情況的上市UC治療藥物。組織-內(nèi)鏡粘膜改善被定義為內(nèi)鏡改善(Mayo內(nèi)鏡subscore 0或1)和結腸組織學改善(隱窩內(nèi)性粒細胞浸潤<5%,沒有隱窩破壞,沒有侵蝕,潰瘍或肉芽組織)的組合。
內(nèi)鏡和組織學檢查容易因其介入性而在臨床使用受限。因此,以非介入性生物標記物作為治療目標受到了追捧。最近十年超過三分之一的RCTs報道了生物標記物的結果,主要集中在糞衛(wèi)蛋白(FCP)和C反應蛋白。FCP是一種可靠的粘膜炎癥生物標志物,并可預測維持治療期間的響應丟失。然而,以生物標志物為終點的“達標治療(treat-to-target)”方法是否能改善UC的深度緩解仍有待進一步確定。
雖然目前內(nèi)鏡、組織學、生物標記物、無激素緩解等臨床終點主要作為次要終點出現(xiàn),而且其準確界定及對預后的意義仍需更大規(guī)模的前瞻性隊列研究來證實,但“達標治療”的趨勢已不可逆轉,2015年,STRIDE專家委員會確定了炎癥性腸病(IBD)的“達標治療”方案,將UC治療的目標轉變?yōu)轭A防長期疾病并發(fā)癥(異形增生/癌變、住院治療、結腸切除術),同時建議監(jiān)測UC的客觀疾病活動(如內(nèi)鏡炎癥證據(jù))。可以想象未來IBD治療的臨床終點中除了基本的臨床緩解外,上述甚至更多的目標將日益被醫(yī)生和FDA接受,成為預后和評價治療藥物的重要終點。
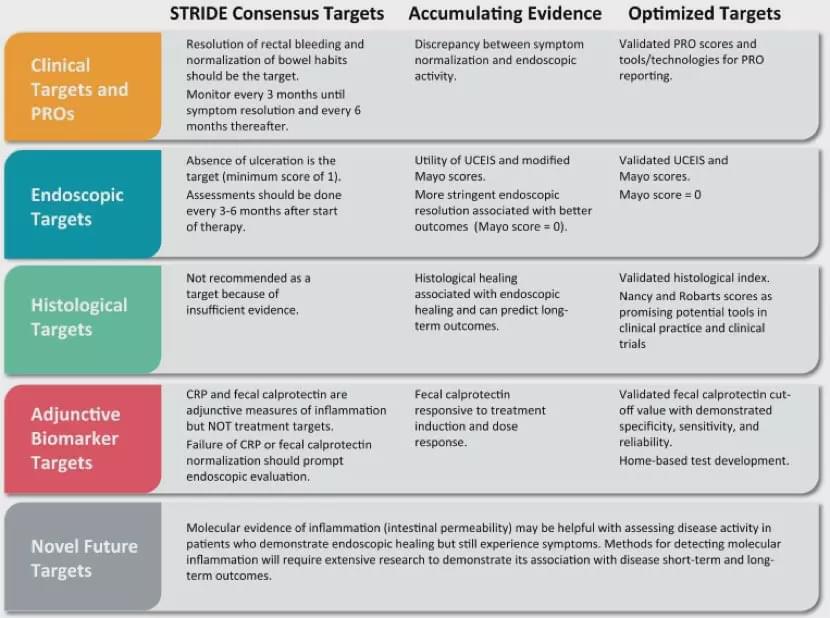
UC管理中累積的證據(jù)和特定目標的演進
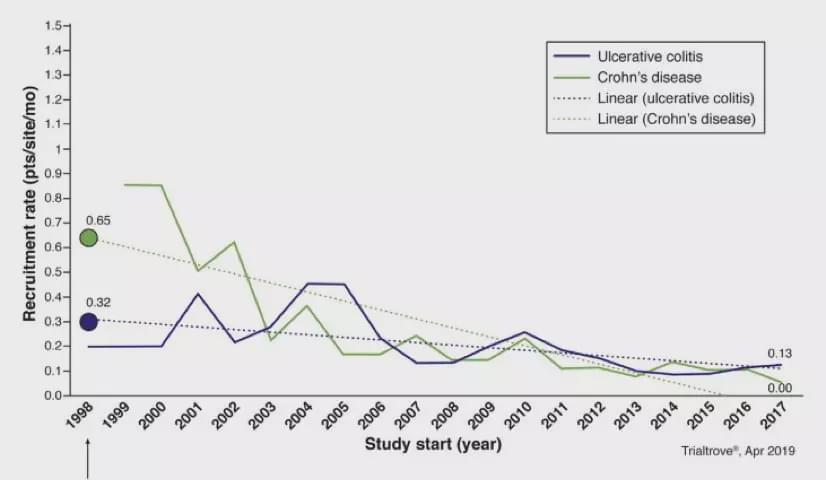
Informa的一項調(diào)查顯示,自從IFX首次獲批用于IBD適應癥的20多年來(1998年以來),中重度UC每個臨床中心的平均招募率為從0.32 降到0.13例/月,而中重度CD每個臨床中心的平均招募率從0.65例降至0.0-0.10例/月(如下圖所示)。1998年,總共有7次中重度IBD臨床試驗, 包括3個UC和4個CD;到2018年,已經(jīng)增加到147個臨床試驗,包括84個UC和63個CD。這些趨勢迫使制藥公司不得不在全球范圍內(nèi)尋找可以參加IBD臨床試驗的中心。
分析原因可能包括:在研藥物數(shù)量的增加;相對于加入臨床研究使用在研藥物或安慰劑,其他的治療選擇明顯增多;臨床試驗設計的復雜性增加;篩選患者失敗率增加。
尤其第二點原因容易被忽略。新藥的涌現(xiàn)增加了醫(yī)生和患者的選擇空間,但同時也降低了他們進入安慰劑對照研究的意愿,尤其是不提供長期擴展的二期試驗。傳統(tǒng)治療失去響應的患者,一般會尋求新藥,但在便宜、可及的生物類似藥面前也有了更多的選擇。生物制劑的大量應用也使得招募沒有生物制劑治療史的患者越來越困難。此外,試驗流程中需要一定的洗脫期(通常5個半衰期),這對于超長半衰期的生物制劑來說,無疑會使患者長期暴露在無藥控制或使用激素等其他藥物的狀態(tài)下,導致不少患者望而卻步。
盡臨床前評價模型轉化效率低
動物模型是探索疾病發(fā)生機制,并為治療效果提供概念驗證的重要工具。然而,胃腸道系統(tǒng)中宿主遺傳和環(huán)境因素獨特的相互作用使建立IBD替代物種的模型非常具有挑戰(zhàn)性。即使比較成熟的結腸炎模型也會受到重復性問題的困擾,這可能部分歸因于不同實驗室條件下微生物的差異。盡管如此,臨床前動物模型仍然在為IBD病理生理機制及治療評價研究“任勞任怨”地服務。
已經(jīng)有多種IBD小鼠模型,從化學誘導的結腸炎模型到基因模型再到免疫改造或特殊菌群添加的模型。可是,至今沒有一個模型能充分預測治療的結果。每一種體內(nèi)模型都有其適用性,穩(wěn)健的科學研究關鍵仍然是謹慎地選擇正確的模型來解決對應的科學問題,而不是將其直接轉化為臨床療效。簡單的右旋糖酐硫酸酯鈉(DSS)誘導模型以及它所引起的損傷和炎癥產(chǎn)生了大量科研論文,但卻沒有給患者帶來直接的益處。例如,已經(jīng)證明臨床療效的抗TNFα和抗IL-12/23p40抗體在化學誘導的結腸炎模型上是無效的。這可能是因為這些模型還只是短期的急性損傷而不是遺傳易感人群發(fā)展多年的持續(xù)的疾病過程。而在其他模型,比如T細胞轉移鼠(幼稚T細胞轉移到Rag null或SCID突變小鼠),抗炎治療卻是非常有效的。
但是,即使小鼠對給定的治療反應一致,但現(xiàn)實中卻沒有一種治療方法能充分治療所有IBD患者,這也表明需要多種模型來探索人類疾病的不同方面。理解哪些模型能充分代表人類疾病的不同方面是理解何時以及如何使用一種模型而不是另一種模型來解決與通路和治療相關的適當機制問題的關鍵。
此外,具有顯著且常常是嚴重免疫缺陷的遺傳突變的小鼠讓我們對IBD的免疫發(fā)病機制有了更深入的了解;然而,在這些小鼠身上的發(fā)現(xiàn)僅僅帶來了少量的治療方法,幫助了美國200多萬以及全世界數(shù)百萬IBD患者中的一小部分。最近的一個例子是IL -17抗體(Secukinumab)不僅不能對CD患者產(chǎn)生益處,而且還加重了一些患者的癥狀。動物模型研究發(fā)現(xiàn),白細胞介素-23 (IL-23)促進腸道炎癥的關鍵作用是通過IL-6和IL-17A等炎癥介質(zhì)實現(xiàn)的。與IL-17A在IBD中具有更為復雜的免疫調(diào)節(jié)作用相一致,其他動物模型的結果也提示IL-17A在IBD中具有保護作用。在活動性克羅恩病中發(fā)現(xiàn)12例糞便中IL-17A水平升高,同時克羅恩病患者固有層中分泌IL-23和IL-17A細胞數(shù)量增加。2006年,北美IBD遺傳學協(xié)會在一項全基因組關聯(lián)研究中首次報道IL-23R與克羅恩病易感性的強基因關聯(lián)。后來,在獨立地全基因組關聯(lián)研究群組上這種聯(lián)系的進一步證據(jù)被看到,提示IL-23-IL-17軸在疾病發(fā)病機制中的作用,并為IL-17A在克羅恩病中的作用提供間接證據(jù)。結果,在一項Secukinumab的2期臨床試驗中,第6周時,Secukinumab治療未能將CDAI均值較安慰劑降低≥50分,錯過了主要終點,并滿足了IA中預先指定的無效標準。這項研究被提前終止,結果還表明,IL-17A的抑制可能對一組有炎癥客觀證據(jù)的患者產(chǎn)生不良結果。
另一個類似地例子,盡管對IL10 -/-小鼠發(fā)生的自發(fā)性結腸炎進行了大量研究,證明了這種抗炎性細胞因子在腸道炎癥中的重要性,但21項針對IBD患者的IL-10治療試驗并沒有顯示出顯著的有益效果。這可能是由于IL-10受體的多態(tài)性阻礙了這種治療的有效性,或者是IL-10在體內(nèi)的不穩(wěn)定性和短半衰期。但無論如何,在人類IBD的陰性結果證實了動物數(shù)據(jù)外推到人類的不可預測性。
近來,在模型方面有兩個最新進展,一是人源化小鼠模型的開發(fā)(人類免疫細胞嫁接到免疫缺陷小鼠),二是外植體的使用或直接從人類IBD患者腸道組織分離的固有層單核細胞(lamina propria mononuclear cells),他們可以讓研究人員直接在人類細胞和/或組織上驗證療效,相信可以有效提高臨床轉化效率。
總結
對于big pharma 來說,立項要考慮的因素很多,包括公司的戰(zhàn)略布局、市場營銷能力等,產(chǎn)品的價值和風險只是其中一個維度而已,但對于biotech 公司來說,核心項目的選擇對公司來說則是生死攸關。這時產(chǎn)品的價值和風險幾乎是biotech公司的全部。
結合上述IBD領域的趨勢和我們對部分相關biotech公司的了解,我們認為biotech公司在IBD領域立項前應該思考如下幾個問題:
一、IBD雖然有較多未滿足的臨床需求,但自己的產(chǎn)品定位是否屬于真正的未滿足的臨床需求?如果是,這個需求有多大?比如:我們認為對于一個biotech公司,如果單純改變給藥途徑面臨的風險將較大,可能不足以支持其管線的商業(yè)價值。安全性和依從性甚至包括療效的組合提升才是創(chuàng)業(yè)公司更好的選擇。
二、IBD領域隨著新藥的涌現(xiàn),市場放量會放緩甚至未被占據(jù)的市場份額都在萎縮,新產(chǎn)品尤其是發(fā)揮核心作用的新MOA產(chǎn)品的立項需要考慮這些變化,是否還有較大把握從現(xiàn)有“魚塘”中捕獲足夠的“魚”?相反,圍繞核心地位產(chǎn)品的聯(lián)合治療(比如低毒的局部的粘膜或屏障修復或維持藥物)或者圍繞安全性或順應性的深度挖掘是否可能另辟蹊徑?
三、臨床資源也在快速萎縮,是否有足夠的能力、資金和時間來運作一個較大規(guī)模的臨床研究?如何更巧妙的設計臨床試驗,以為上市后產(chǎn)品增加競爭力?
四、IBD領域臨床前評價模型與臨床結果之間關聯(lián)性較弱,如何選擇合適的臨床前評價模型?對于新的MOA,如果能有臨床上biomarker的指征,或全新的藥物發(fā)現(xiàn)技術,將可能提高新產(chǎn)品的研發(fā)成功率。
未來最有價值的IBD新藥將符合以下特征中的一個或幾個:
1、全新機制,能夠較大比例地解決現(xiàn)有藥物無法誘導達到完全緩解的患者或者難治性/復發(fā)性患者。
2、解決現(xiàn)有藥物的依從性和安全性等問題,擴大治療窗。
3、誘導緩解并且能夠達到“深度緩解”。
4、加速緩解或提高預后的輔助治療或聯(lián)合治療。
參考
[1]AGA Clinical Practice Guidelines on the Management of Moderate to Severe Ulcerative Colitis. [Epub ahead of print] Gastroenterology. 2020 Jan 13. DOI: 10.1053/j.gastro.2020.01.006
[2]AGA Technical Review on the Management of Moderate to Severe Ulcerative Colitis. [Epub ahead of print]. Gastroenterology. 2020 Jan 13. doi: 10.1053/j.gastro.2020.01.007.
[3]The IBD Therapeutic Pipeline is Primed to Produce. PRACTICAL GASTROENTEROLOGY
[4]Genentech Research and Early Development (gRED).
https://www.roche.com/dam/jcr:46f31db2-73e5-4129-b1c4-e2d72233af5d/en/irp20200218.pdf
[5]Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. The Lancet, 390(10114), 2769–2778. doi:10.1016/s0140-6736(17)32448-0
[6]Discontinuation of Infliximab in Patients With Ulcerative Colitis Is Associated With Increased Risk of Relapse: A Multinational Retrospective Cohort Study. Clinical Gastroenterology and Hepatology, 14(10), 1426–1432.e1. doi:10.1016/j.cgh.2016.05.044
[7]IM-UNITI: 3 Year Efficacy, Safety, and Immunogenicity of Ustekinumab Treatment of Crohn's Disease. J Crohns Colitis 2019. doi:10.1093/ecco-jcc/jjz110
[8]The Present and Future of Inflammatory Bowel Disease Treatment.Gastroenterology & Hepatology Volume 12, Issue 7 July 2016
[9]Ustekinumab as Induction and Maintenance Therapy for CD. N Engl J Med 2016;375:1946-60. DOI: 10.1056/NEJMoa1602773.
[10]Ustekinumab as Induction and Maintenance Therapy for UC. N Engl J Med 2019;381:1201-14. DOI: 10.1056/NEJMoa1900750.
[11]Personalising medicine in inflammatory bowel disease—current and future perspectives. Transl Pediatr 2019;8(1):56-69. doi: 10.21037/tp.2018.12.03
[12]Heterogeneity in Definitions of Endpoints for Clinical Trials of Ulcerative Colitis: A Systematic Review for Development of a Core Outcome Set. Clinical Gastroenterology and Hepatology, 16(5), 637–647. doi:10.1016/j.cgh.2017.08.025
[13]Ulcerative Colitis: Clinical Trial Endpoints Guidance for Industry
[14]A Treat-to-Target Update in Ulcerative Colitis: A Systematic Review. Am J Gastroenterol 2019;114:874–883. https://doi.org/10.14309/ajg.0000000000000183
[15]Competition for clinical trails in IBD. Gastroenterology 2019;157:1457–1461. https://doi.org/10.1053/j.gastro.2019.08.020
[16]Challenges in IBD 2019. 2019 Crohn’s & Colitis Foundation
4月22日,上海蛋品世界科技館內(nèi),“航天賦能 標準領航 營養(yǎng)領鮮”——中國航天生態(tài)農(nóng)產(chǎn)品標準發(fā)布暨圣...
 2025-04-25
2025-04-25被發(fā)際線后移、頭頂稀疏困擾的發(fā)友們注意了!一則驚爆發(fā)友圈的重磅消息來了,2025 年 4 月 27 ...
 2025-04-25
2025-04-25近日,華納藥廠(688799.SH)子公司上海致根醫(yī)藥科技有限公司在研創(chuàng)新藥項目ZG-001膠囊,已...
 2025-04-25
2025-04-25提前消費意識的覺醒帶動了金融借貸服務行業(yè)的發(fā)展,而年輕人自主拼搏不甘落后的特征則為小微企業(yè)的開創(chuàng)奠定...
 2025-04-25
2025-04-25歐林生物(688319.SH)于4月25日晚間披露《2025年第一季度報告》。
 2025-04-25
2025-04-25為了確保每位客戶的需求都能得到及時響應,特別設立了全國客服無論您是在申請貸款過程中遇到困難,還是對現(xiàn)...
 2025-04-25
2025-04-252025 年 04 月,在全球矚目的巴黎區(qū)塊鏈周(Paris Blockchain Week)上,B...
 2025-04-25
2025-04-25在全球應對氣候變化、推動可持續(xù)發(fā)展的背景下,第四屆國際綠色零碳節(jié)暨2025 ESG領袖峰會將于202...
 2025-04-25
2025-04-25投資家網(wǎng)(www.51baobao.cn)是國內(nèi)領先的資本與產(chǎn)業(yè)創(chuàng)新綜合服務平臺。為活躍于中國市場的VC/PE、上市公司、創(chuàng)業(yè)企業(yè)、地方政府等提供專業(yè)的第三方信息服務,包括行業(yè)媒體、智庫服務、會議服務及生態(tài)服務。長按右側二維碼添加"投資哥"可與小編深入交流,并可加入微信群參與官方活動,趕快行動吧。
